抗氧化功能评价方法
1 动物试验项目
1.1老龄动物
选用10月龄以上大鼠或8月龄以上小鼠,按血中MDA水平分组,随机分为1个溶剂对照组和3个受试样品剂量组。3个剂量组给予不同浓度受试样品,对照组给予同体积溶剂,1次/d,连续30d。实验结束时处死动物测脂质氧化产物含量、蛋白质羰基含量、还原性谷胱甘肽含量、抗氧化酶活力。
1.2 D-半乳糖氧化损伤模型
1.2.1原理:D-半乳糖供给过量,超常产生活性氧,打破了受控于遗传模式的活性氧产生与消除的平衡状态,引起过氧化效应。
1.2.2造模方法:选25-30g健康成年小鼠,除空白对照组外,其余动物用D-半乳糖40mg-1.2g/kg BW颈背部皮下注射或腹腔注射造模,注射量为0.1mL/10g,每日1次,连续造模6周,取血测MDA,按MDA水平分组。随机分为1个模型对照组和3个受试样品剂量组,3个剂量组经口给予不同浓度受试样品,模型对照组给予同体积溶剂,在给受试样品的同时,模型对照组和各剂量组继续给予相同剂量D-半乳糖颈背部皮下或腹腔注射,实验结束处死动物测脂质氧化产物含量、蛋白质羰基含量、还原性谷胱甘肽含量、抗氧化酶活力。
1.3 乙醇氧化损伤模型
1.3.1原理:乙醇大量摄入,激活氧分子产生自由基,导致组织细胞过氧化效应及体内还原性谷胱甘肽的耗竭。
1.3.2 造模方法:选25-30g健康成年小鼠(180-220g大鼠),随机分为4个组,1个模型对照组和3个受试样品剂量组,必要时可增设1个空白对照组。3个剂量组给予不同浓度受试样品,模型对照组给予同体积溶剂,连续灌胃30天,末次灌胃后,模型组对照组和3个剂量组禁食16小时(过夜),然后1次性灌胃给予50%乙醇12ml/kgBW,6小时后取材(空白对照组不作处理,不禁食取材),测血清或肝组织脂质氧化产物含量、蛋白质羰基含量、还原性谷胱甘肽含量、抗氧化酶活力。
2 试验原则
2.1 动物实验和人体试食试验所列的指标均为必测项目。
2.2 脂质氧化产物指标中丙二醛和血清8-表氢氧异前列腺素任选其一进行指标测定,动物实验抗氧化酶指标中超氧化物歧化酶和谷胱甘肽过氧化物酶任选其一进行指标测定。
2.3 氧化损伤模型动物和老龄动物任选其一进行生化指标测定。
3 动物试验结果判定
化产物、蛋白质氧化产物、抗氧化酶、抗氧化物质四项指标中三项阳性,可判定该受试样品抗氧化功能动物实验结果阳性。
抗氧化功能检验方法
Method for the Assessment of Antioxidative Function
1 动物实验
1.1 实验动物
选用10月龄以上老龄大鼠或8月龄以上老龄小鼠,也可用氧化损伤模型鼠。单一性别,小鼠每组10-15只,大鼠8-12只。
1.2 剂量分组及受试样品给予时间
实验设三个剂量组和一个溶剂对照组,以人体推荐量的10倍(小鼠)或5倍(大鼠)为其中的一个剂量组,另设两个剂量组,高剂量一般不超过30倍,必要时设阳性对照组、空白对照组。受试样品给予时间30天,必要时可延长至45天。
1.3 实验方法
1.3.1 老龄动物
选用10月龄以上大鼠或8月龄以上小鼠,按血中MDA水平分组,随机分为1个溶剂对照组和3个受试样品剂量组。3个剂量组给予不同浓度受试样品,对照组给予同体积溶剂,实验结束时处死动物测脂质氧化产物含量、蛋白质羰基含量、还原性谷胱甘肽含量、抗氧化酶活力。
1.3.2 D-半乳糖氧化损伤模型
1.3.2.1原理
D-半乳糖供给过量,超常产生活性氧,打破了受控于遗传模式的活性氧产生与消除的平衡状态,引起过氧化效应。
1.3.2.2造模方法
选25-30g健康成年小鼠,除空白对照组外,其余动物用D-半乳糖40mg-1.2g/kg BW颈背部皮下注射或腹腔注射造模,注射量为0.1mL/10g,每日1次,连续造模6周,取血测MDA,按MDA水平分组。随机分为1个模型对照组和3个受试样品剂量组,3个剂量组经口给予不同浓度受试样品,模型对照组给予同体积溶剂,在给受试样品的同时,模型对照组和各剂量组继续给予相同剂量D-半乳糖颈背部皮下或腹腔注射,实验结束处死动物测脂质氧化产物含量、蛋白质羰基含量、还原性谷胱甘肽含量、抗氧化酶活力。
1.3.3 乙醇氧化损伤模型
1.3.3.1原理
乙醇大量摄入,激活氧分子产生自由基,导致组织细胞过氧化效应及体内还原性谷胱甘肽的耗竭。
1.3.3.2造模方法
选25-30g健康成年小鼠(180-220g大鼠),随机分为4个组,1个模型对照组和3个受试样品剂量组,必要时可增设1个空白对照组。3个剂量组给予不同浓度受试样品,模型对照组给予同体积溶剂,连续灌胃30天,末次灌胃后,模型组对照组和3个剂量组禁食16小时(过夜),然后1次性灌胃给予50%乙醇12ml/kgBW,6小时后取材(空白对照组不作处理,不禁食取材),测血清或肝组织脂质氧化产物含量、蛋白质羰基含量、还原性谷胱甘肽含量、抗氧化酶活力。
1.3.4脂质氧化产物测定
1.3.4.1 血中过氧化脂质降解产物丙二醛(MDA)含量测定
血中过氧化脂质降解产物丙二醛(MDA)含量可采用荧光法和比色法测定,方法任选其一。
1.3.4.1.1 荧光法
1.3.4.1.1.1 荧光法原理
MDA(malondiadehycle)是细胞膜脂质过氧化的终产物之一,测其含量可间接估计脂质过氧化的程度。1个丙二醛(MDA)分子与2个硫代巴比妥酸(TBA)分子在酸性条件下共热,形成粉红色复合物。以波长536nm为激发光,在550nm有最强荧光强度。可用荧光法进行微量测定。
1.3.4.1.1.2 仪器与试剂
仪器:荧光分光光度计、微量加样器、恒温水浴锅、普通离心机、混旋器、具塞离心管
试剂:
10mmol/L四乙氧基丙烷(贮备液,棕色瓶4℃保存12个月),临用前用纯水稀释成1nmol/mL
29mmol/L硫代巴比妥酸工作液
硫代巴比妥酸 0.209g
EDTA.2H20 25mg
谷胱甘肽(还原型) 1mg
用0.02mol/L NaOH 50 mL 溶解(微温助溶,棕色瓶4℃保存2周)
酸水解液
0.1mol/L H2SO4 125mL
0.1mol/L Na2SO4 125mL
加水150mL用 H2SO4 调pH 1.5,加水稀释至500mL
正丁醇
以上所用玻璃器皿均需经50%硝酸浸泡24h后,再经蒸馏水、双蒸水淋洗干燥,试剂(选AR级)最好用双蒸水配制。
1.3.4.1.1.3 实验步骤
1.3.4.1.1.3.1 样品制备
全血上清液:取血50μl加入0.5mL生理盐水,2000r/min离心10min,取上清液待测。
血清样品:取血0.5mL室温静置10min,2000r/min离心10min,取上清液待测。
1.3.4.1.1.3.2 标准曲线制作
将10nmol/mL四乙氧基丙烷,用双蒸水稀释成0.0、0.25、0.5、1.0、1.5、2、3、5、10nmol/mL分别取0.1mL加入酸水解液 2mL、TBA工作液0.5mL→混匀,避光、沸水浴60min→流水冷却至室温→3mL正丁醇振荡抽提1min→3000r/min离心5min→取上清液(正丁醇层)测荧光强度(入射狭缝1.5nm,出射狭缝5nm, 激发波长536nm,发射波长550nm)
以四乙氧基丙烷浓度为横坐标,荧光强度为纵坐标作图。
1.3.4.1.1.3.3样品测定
| 试剂 | 空白管 | 样本管 | 标准管 |
|
10mL具塞离心管 |
0.1mL蒸馏水 |
0.1mL血清* |
0.1mL标准# |
|
酸水解液 |
2mL |
2mL |
2mL |
|
TBA工作液 |
0.5mL |
0.5mL |
0.5mL |
|
混匀,避光沸水浴60min,流水冷却 |
|||
|
正丁醇 |
3mL |
3mL |
3mL |
|
振荡抽提1min,3000r/min 离心5min |
|||
*全血上清液 0.5mL(空白管加蒸馏水0.5mL,标准管加标准0.1mL、蒸馏水0.4mL)
#1nmol/mL四乙氧基丙烷(标准)
血清0.1mL(或全血上清液0.5mL)→加入酸水解液 2mL、TBA工作液0.5mL→混匀,避光、沸水浴60min→流水冷却至室温→3mL正丁醇振荡抽提1min→3000r/min离心5min→取上清液(正丁醇层)测荧光强度(入射狭缝1.5nm,出射狭缝5nm, 激发波长536nm,发射波长550nm)
1.3.4.1.1.3.4 计算公式:

A:空白管荧光度
B:样品荧光度
F:四乙氧基丙烷荧光度
C:四乙氧基丙烷浓度(1nmol/mL)
K:稀释倍数
1.3.4.1.2比色法
1.3.4.1.2.1比色法原理
MDA(malondiadehycle)是细胞膜脂质过氧化的终产物之一,测其含量可间接估计脂质过氧化的程度。1个丙二醛(MDA)分子与2个硫代巴比妥酸(TBA)分子在酸性条件下共热,形成粉红色复合物。该物质在波长532nm有极大吸收峰。可用分光光法进行测定。
1.3.4.1.2.2 仪器与试剂
仪器:可见光分光光度计、酶标仪、微量加样器、恒温水浴锅、普通离心机、混旋器、具塞离心管。
试剂:0.2M乙酸盐缓冲液 pH3.5
0.2M乙酸溶液 185mL
0.2M乙酸钠溶液 15mL
1mmol/L四乙氧基丙烷(贮备液,4℃保存3个月),临用前用水稀释成40nmol/mL
8.1%十二烷基硫酸钠SDS
0.8%硫代巴比妥酸TBA
0.2M磷酸盐缓冲液 pH7.4
0.2M磷酸氢二钠 1920mL
0.2M 磷酸二氢钾 480mL
1.3.4.1.2.3 实验步骤
1.3.4.1.2.3.1 样品制备
溶血液样品:取血20μL加入0.98mL蒸馏水制成2%溶血液。
1.3.4.1.2.3.2样品测定
| 试剂 | 空白管 | 样品管 | 标准管 |
|
2%溶血液* |
|
0.2mL |
|
|
40nmol/mL四乙氧基丙烷 |
|
|
0.2mL |
|
8.1%SDS |
0.2mL |
0.2mL |
0.2mL |
|
0.2M乙酸盐缓冲液 |
1.5mL |
1.5mL |
1.5mL |
|
0.8%TBA |
1.5mL |
1.5mL |
1.5mL |
|
H2O |
0.8mL |
0.6mL |
0.6mL |
|
混匀,避光沸水浴60min,流水冷却,于532nm比色 |
|||
注:如用试剂盒,可按试剂盒的操作要求进行。
*若用血清,样品管0.15mL,标准管0.15mL。
1.3.4.1.2.3.3计算
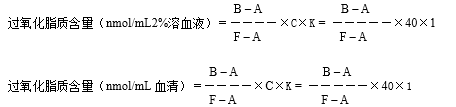
A: 空白管吸光度
B:样品吸光度
F:四乙氧基丙烷吸光度
C:四乙氧基丙烷浓度(40nmol/mL)
K:稀释倍数
1.3.4.2组织中过氧化脂质降解产物丙二醛(MDA)含量测定
1.3.4.2.1 原理
见1.3.4.1.2.1
1.3.4.2.2 仪器与试剂
仪器:可见光分光光度计、酶标仪、微量加样器、恒温水浴锅、普通离心机、混旋器、具塞离心管、组织匀浆器
试剂:见1.3.4.1.2.2
1.3.4.2.3 实验步骤
1.3.4.2.3.1 样品制备
组织匀浆样品:取一定量的所需脏器,生理盐水冲洗、拭干、称重、剪碎,置匀浆器中,加入0.2M磷酸盐缓冲液,以20000r/min匀浆10s,间歇30s,反复进行3次,制成10%组织匀浆(W/V),3000r/min离心5-10min,取上清液待测。
1.3.4.2.3.2样品测定
|
试剂 |
空白管 | 样品管 | 标准管 |
|
10%组织匀浆 |
|
0.2mL |
|
|
40nmol/mL四乙氧基丙烷 |
|
|
0.2mL |
|
8.1%SDS |
0.2mL |
0.2mL |
0.2mL |
|
0.2M乙酸盐缓冲液 |
1.5mL |
1.5mL |
1.5mL |
|
0.8%TBA |
1.5mL |
1.5mL |
1.5mL |
|
H2O |
0.8mL |
0.7mL |
0.7mL |
|
混匀,避光沸水浴60min,流水冷却,于532nm比色 |
|||
注:如用试剂盒,可按试剂盒的操作要求进行
1.3.4.2.3.3计算

A: 空白管吸光度
B:样品管吸光度
F:四乙氧基丙烷吸光度
C:四乙氧基丙烷浓度(40nmol/mL)
K:稀释倍数
1.3.4.3 血清中8-表氢氧-异前列腺素(8-Isoprostane)测定
1.3.4.3.1原理
8-表氢氧-异前列腺素(8-Isoprostane)是体内脂质氧化应激反应稳定而具有特异性的标志物,其含量能间接反应因机体内自由基的产生而导致组织细胞的脂质过氧化程度。
1.3.4.3.2仪器与试剂
仪器:酶标仪、生化培养箱、微量振荡器、微量加样器、洗板机
试剂:8-Isoprostane KIA Kit (酶联免疫试剂盒)
8-Isoprostane EIA 抗体血清、8-Isoprostane AChE示踪物、8-Isoprostane EIA标准品、EIA缓冲液、洗涤缓冲液、吐温20、鼠抗-兔IgG抗体、EIA示踪染色剂、EIA抗体血清染色剂、Ellman’s试剂
1.3.4.3.3实验步骤
1.3.4.3.3.1样品制备
小鼠眼内眦静脉丛取血,3000r/min离心10min。取上清液,用EIA 缓冲液稀释15倍备用。
1.3.4.3.3.2样品测定
按试剂盒说明操作。
8-表氢氧异前列腺素标准孔浓度分别为:500 pg/mL、200 pg/mL、80 pg/mL、32 pg/mL、12.8 pg/mL、5.1 pg/mL、2.0 pg/mL、0.8pg/mL
|
步骤 |
试剂 |
空白 |
TA |
NSB |
B0 |
标准/样品 |
|
1.加试剂 |
EIA 缓冲液 |
- |
- |
100μL |
50μL |
- |
|
标准/样品 |
- |
- |
- |
- |
50μL |
|
|
AChE示踪物 |
- |
- |
50μL |
50μL |
50μL |
|
|
抗体血清 |
- |
- |
- |
50μL |
50μL |
|
|
2.培养 |
用封板膜盖好酶标板,并在4℃避光条件下培养18小时 |
|||||
|
3.清洗 |
清洗所有反应孔五次 |
|||||
|
4.加试剂 |
AChE示踪物 |
- |
5μL |
- |
- |
- |
|
Ellman’s |
200μL |
200μL |
200μL |
200μL |
200μL |
|
|
5.培养 |
用封板膜盖好酶标板,并在常温避光条件下培养45-90分钟 |
|||||
|
6.读数 |
在波长412nm处测量各孔吸光度(B0在 0.3-1.0 A.U范围) |
|||||

以标准物的浓度的对数(log)为横坐标,%B/B0为纵坐标绘制标准曲线,亦可将数据转换成logit(B/B0)或ln[B/B0/(1-B/B0)]做为纵坐标绘制标准曲线,计算回归方程。将样品的%B/B0值,代入方程式,计算出样品的浓度,再乘以稀释倍数,即为样品中的8-表氢氧异前列腺素浓度。
1.3.5蛋白质氧化产物测定
H2O2或O2·ˉ自由基对蛋白质氨基酸侧链的氧化可导致羰基产物的积累。羟自由基也可直接作用于肽链,使肽链断裂,引起蛋白质一级结构的破坏,在断裂处产生羰基。羰基化蛋白极易相互交联、聚集为大分子从而降低或失去原有蛋白质的功能,蛋白质羰基含量可直接反映蛋白质损伤的程度。蛋白质羰基形成是多种氨基酸在蛋白质的氧化修饰过程中的早期标志,它随着年龄的增长而增加。
1.3.5.1血清中蛋白质羰基测定
1.3.5.1.1原理
被氧化后的蛋白质羰基含量增多,羰基可与2,4-二硝基苯肼反应生成2,4-二硝基苯腙,2,4.二硝基苯腙为红棕色的沉淀,将沉淀用盐酸胍溶解后即可在分光光度计上读取370 nm下的吸光度值,从而测定蛋白质的羰基含量。
1.3.5.1.2仪器与试剂
仪器:紫外分光光度计、酶标仪、微量加样器、生化培养箱、恒温水浴锅、低温高速离心机、混旋器、2ml离心管。
试剂:10 mmol/L 2,4-二硝基苯肼(DNPH)
99毫克2,4-二硝基苯肼用50ml 2 mol/L HCL 溶解,4℃避光保存。
2 mol/L HCL
200 g/L 三氯乙酸(TCA)
6 mol/L 盐酸胍
无水乙醇乙酸乙酯混合应用液
将无水乙醇和乙酸乙酯按照体积比1:1的比例配置成混合溶液,现用现配。
1.3.5.1.3操作步骤
|
试剂 |
测定管 |
对照管 |
|
血清(血浆) |
0.1ml |
0.1ml |
|
10 mmol/L 2,4-二硝基苯肼 |
0.4ml |
|
|
2 mol/L HCL |
|
0.4ml |
|
涡旋混匀1分钟,37℃准确避光反应30分钟 |
||
|
200 g/L 三氯乙酸 |
0.5ml |
0.5ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
6 mol/L 盐酸胍 |
1.25ml |
1.25ml |
|
混匀后,37℃准确水浴15分钟 |
||
涡旋混匀,将全部沉淀溶解,以12000r/min离心15min,取上清液在370nm处比色,6 mol/L 盐酸胍试剂调零,测定OD值。用双缩脲法测定血清(或血浆)蛋白质含量。
注:如用试剂盒,可按试剂盒的操作要求进行。
1.3.5.1.4计算公式

1.3.5.2组织中蛋白质羰基测定
1.3.5.2.1原理
见1.3.5.1.1
1.3.5.2.2 仪器与试剂
仪器:紫外分光光度计、酶标仪、微量加样器、生化培养箱、恒温水浴锅、天平、匀浆器、低温高速离心机、混旋器、2ml离心管。
试剂:
10 mmol/L HEPES缓冲液 pH7.4
2.38克N-2-羟乙基哌嗪-2’-乙磺酸(HEPES)溶入1000ml双蒸馏水,用lN NaOH 调pH至7.4,4℃保存。
100 g/L 硫酸链霉素
1g硫酸链霉素,溶入10ml双蒸馏水,4℃避光保存。
10 mmol/L 2,4-二硝基苯肼(DNPH)
99毫克2,4-二硝基苯肼用50ml 2 mol/L HCL 溶解,4℃避光保存。
2 mol/L HCL
200 g/L 三氯乙酸(TCA)
6 mol/L 盐酸胍
无水乙醇乙酸乙酯混合应用液
将无水乙醇和乙酸乙酯按照体积比1:1的比例配置成混合溶液,现用现配。
1.3.5.2.3 实验步骤
1.3.5.2.3.1样品处理
取0.1g组织,在冰的生理盐水中漂洗,以去掉表面的血迹。加人0.9ml的冰的10 mmol/L HEPES缓冲液(pH7.4),制成10% 的匀浆。将匀浆液以3000r/min的转速,离心10 min,保留上清。取100g/L的硫酸链霉素溶液50µl,加入上清液450µl(v/v,1:9),室温放置10 min后,以11000r/min的转速,离心10 min,取上清液待测。
1.3.5.2.3.2操作步骤
|
试剂 |
测定管 |
对照管 |
|
组织匀浆上清液 |
0.1ml |
0.1ml |
|
10 mmol/L 2,4-二硝基苯肼 |
0.4ml |
|
|
2 mol/L HCL |
|
0.4ml |
|
涡旋混匀1分钟,37℃准确避光反应30分钟 |
||
|
200 g/L 三氯乙酸 |
0.5ml |
0.5ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
无水乙醇乙酸乙酯混合应用液 |
1.0ml |
1.0ml |
|
涡旋混匀1分钟,以4℃下,以12000r/min离心10min,弃上清,留沉淀 |
||
|
6 mol/L 盐酸胍 |
1.25ml |
1.25ml |
|
混匀后,37℃准确水浴15分钟 |
||
涡旋混匀,将全部沉淀溶解,以12000r/min离心15min,取上清液在370nm处比色,6 mol/L 盐酸胍试剂调零,测定OD值。用双缩脲法测定匀浆上清液蛋白质含量。
注:如用试剂盒,可按试剂盒的操作要求进行。
1.3.5.2.3.3计算公式

1.3.5.3 注意事项
1.3.5.3.1 加入硫酸链霉素:在匀浆上清液中加人硫酸链霉素溶液的作用是沉淀核酸。核酸中的一些碱基如鸟嘌呤、胞嘧啶、尿嘧啶和胸腺嘧啶等也含有羰基,如不去除核酸,这些碱基就会与DNPH结合,并反应生成有色物质,这些物质会增加最后溶液的吸光度,使结果偏大 。
1.3.5.3.2 DHPH的溶解:DNPH不溶于水,只能溶于稀酸和稀碱等溶液,因此,用2 mol/L HC1来溶解DNPH。设对照管是为了避免HC1与反应液中一些物质反应生成对比色有影响的物质。
1.3.5.3.3 反应体系应避光:当蛋白质溶液中加人DNPH进行反应时,反应体系需置于黑暗中,因为DNPH不稳定,见光会分解。如果反应体系遇到光,DNPH分解,体系中会有剩余的没有变成蛋白质腙衍生物,对反应比色有影响。
1.3.5.3.4 去除未与蛋白质结合的DNPH:由于DNPH在370nm左右有强烈的光吸收,因而用乙醇和乙酸乙脂混合物反复洗涤沉淀,去掉未与蛋白质结合的DNPH,否则,会增加吸光值。
1.3.6 抗氧化酶活力测定
SOD催化超氧阴离子自由基(O2·ˉ)生成H2O2,再由其它抗氧化酶如谷胱甘肽过氧化物酶(GSH-PX)和过氧化氢酶作用生成水,这样可以清除O2·ˉ对细胞的毒害作用。SOD、GSH-Px在动物某些器官和人体血红细胞中的含量均有明显的增龄变化,酶活性与生物年龄的增长成反比。消除自由基的能力与酶活性成正比。
1.3.6.1 血或组织中超氧化物歧化酶(SOD)活力测定
1.3.6.1.1 原理
O2·ˉ氧化羟胺的最终产物为亚硝酸盐,后者在对氨基苯磺酸及甲萘胺作用下呈现紫红色,在波长530nm处有极大吸收峰,可用分光光度法进行测定,当SOD消除O2·ˉ后形成的亚硝酸盐减少。
1.3.6.1.2仪器与试剂
仪器 可见光分光光度计、酶标仪、离心机、恒温水浴、匀浆器
试剂 65mM磷酸盐缓冲液(PBS) pH7.8
10mmol/L盐酸羟胺
盐酸羟胺6.95mg,加PBS至10mL
7.5mmol/L黄嘌呤
黄嘌呤11.41mg,加0.1M NaOH 2.5mL溶解,加PBS至10mL
0.2g/L黄嘌呤氧化酶
取10g/L黄嘌呤氧化酶0.2mL加冰冷PBS 9.8mL至10mL
0.1%甲萘胺
取0.2gα-甲萘胺溶于40mL沸蒸馏水,凉至室温加50mL冰醋酸,再加110mL凉蒸馏水至200mL
0.33%对氨基苯磺酸
取0.66g对氨基苯磺酸溶于150mL温蒸馏水,加50mL冰醋酸至200mL
SOD标准品
三氯甲烷
95%乙醇(v/v)
0.9%生理盐水
1.3.6.1.3 实验步骤
红细胞抽提液制备:10μl全血冲入0.5mL生理盐水,2000r/min离心3min,弃上清,加冰冷的双蒸水0.2mL混匀,加入95%乙醇0.1mL,振荡30s,加入三氯甲烷0.1mL,置快速混合器抽提1min,4000r/min离心3min,分层,上层为SOD抽提液,中层为血红蛋白沉淀物,下层为三氯甲烷,记录上清液体积待测。
组织匀浆的制备:剪取一定量的所需脏器,生理盐水冲洗、拭干、称重、剪碎,至玻璃匀浆器中加入冷生理盐水20000r/min匀浆10s,间歇30s,反复进行三次,制成1%组织匀浆,(最好用超声波发生器处理30s),使线粒体振破,以中性红-詹钠氏绿B染色证明线粒体已振碎。以4000r/min离心5min,取上清液20μl待测。
SOD标准抑制曲线 将SOD标准品用磷酸盐缓冲液配制成750U/mL的溶液,再稀释到50倍,即SOD量为15U/mL(1.5μg/mL),用本法测定不同量的SOD标准液的百分抑制率,以百分抑制率为纵坐标,以SOD活力单位U/mL为横坐标绘制标准曲线。

计算每mL反应液中SOD抑制率达50%时所对应的SOD量为一个单位。

也可用酶比活法即以每管样品的百分抑制率从SOD标准曲线查出相应的SOD U/mL,乘以稀释倍数(1mL/取样量)。
若样品为组织匀浆液,根据匀浆浓度或组织蛋白质含量,将单位换算为U/g组织或U/mg蛋白。若样品为红细胞抽提液,根据血红蛋白含量,可换算为U/g Hb。
样品测定步骤:
| 试剂 | 测定管 | 对照管 |
|
1/15mol/L磷酸盐缓冲液 pH7.8(mL) |
1.0 |
1.0 |
|
样品 |
A* |
|
|
10mmol/L盐酸羟胺(mL) |
0.1 |
0.1 |
|
7.5mmol/L黄嘌呤(mL) |
0.2 |
0.2 |
|
0.2mg/mL黄嘌呤氧化酶(mL) |
0.2 |
0.2 |
|
双蒸水(mL) |
0.49 |
0.49 |
| 混匀,37℃恒温水浴30min | ||
|
0.33%对氨基苯磺酸(mL) |
2.0 |
2.0 |
|
0.1%甲萘胺(mL) |
2.0 |
2.0 |
| 混匀15min后,倒入1cm光径比色杯,以蒸馏水调零,530nm处比色测定OD值。 | ||
* A 所用样品的量
|
红细胞抽提液 |
10 μl |
|
血清(或血浆) |
20-30 μl(溶血样品剔除) |
|
1%组织匀浆 |
10-40 μl |
注:如用试剂盒,可按试剂盒的操作要求进行。
1.3.6.2 血或组织中谷胱甘肽过氧化物酶(GSH-Px)活力测定
1.3.6.2.1 原理
谷胱甘肽过氧化物酶(GSH-Px)是体内存在的一种含硒清除自由基和抑制自由基反应的系统。对防止体内自由基引起膜脂质过氧化特别重要,其活力以催化GSH氧化的反应速度,及单位时间内GSH减少的量来表示,GSH和5,5’-二硫对硝基苯甲酸(DTNB)反应在GSH-Px催化下可生成黄色的5-硫代2-硝基苯甲酸阴离子,于423nm波长有最大吸收峰,测定该离子浓度,即可计算出GSH减少的量,由于GSH能进行非酶反应氧化,所以最后计算酶活力时,必须扣除非酶反应所引起的GSH减少。
1.3.6.2.2 试剂和仪器
仪器:可见光分光光度计、酶标仪、低温高速离心机、匀浆器、恒温水浴锅、微量加样器
试剂:叠氮钠磷酸缓冲液 pH7.0
|
NaN3 |
16.25mg |
终浓度2.5mmol/L |
|
EDTA-Na2 |
7.44mg |
终浓度0.2mmol/L |
|
Na2HPO4 |
1.732g |
终浓度0.2mol/L |
|
NaH2PO4 |
1.076g |
终浓度0.2mol/L |
加蒸馏水至100mL,用少量HCL、NaOH调pH7.0,4℃保存。
1mmol/L谷胱甘肽(还原型GSH)溶液
GSH 30.7mg加叠氮钠磷酸缓冲液至100mL,临用前配制,冰冻保存1-2日。
1.25-1.5mmol/LH2O2溶液
取30%H2O2 0.15-0.17mL,用双蒸水稀释至100mL,作为贮备液,4℃避光保存,临用前将贮备液用双蒸水稀释10倍即可。
偏磷酸沉淀液
|
HPO3 |
16.7g(先用蒸馏水溶解) |
|
EDTA |
0.5g |
|
NaCl |
280g |
加蒸馏水至1000mL,用普通滤纸过滤,室温保存。
0.32mol/LNa2HPO4溶液:
Na2HPO4 22.7g加蒸馏水至500mL,室温保存。
DTNB显色液
|
DTNB |
40mg |
|
柠檬酸三钠 |
1.0g |
加蒸馏水至100mL,4℃避光保存1个月。
0.2M磷酸缓冲液pH7.4
0.9%生理盐水
1.3.6.2.3 实验步骤
1.3.6.2.3.1 样品制备
溶血液:取鼠血10μl加入到1mL双蒸水中,充分振摇,使之全部溶血1:100待测,4h内测定酶活力。若当天来不及测定,将肝素抗凝全血置-20℃冻存,3d内测定,若4℃存放,28h内必须测完。测前取出样品室温自然解冻。
组织上清液:动物禁食过夜,处死后,立即取出所需脏器,放入冷生理盐水中洗去浮血,剔除脂肪及结缔组织,滤纸吸干后,在冰浴上剪成碎块,称取适量组织,加冷0.2M磷酸缓冲液,以20000r/min匀浆10s,间歇30s,反复3次制成5%组织匀浆,操作在冰浴中进行,匀浆以12500×g离心10min(低温高速离心机),以沉淀为破碎的细胞、细胞碎片、核及线粒体,上清液用以测胞液中的酶活力,最好当天测,否则加20%(v/v)甘油分装于塑料管,放置-20--80℃,可保存数周,而酶活力不减。
1.3.6.2.3.2 GSH标准曲线的制作:
取1.0mmol/LGSH溶液0、0.2、0.4、0.6、0.8、1.0mL,分别置于10mL小容器瓶中,各加入偏磷酸沉淀剂8mL,用双蒸水稀释至10mL刻度,即得到浓度为0、20、40、60、80、100μmol/L的 GSH标准液。
取上述不同浓度标准液各2mL,放入试管中,加入0.32mol/L Na2HPO4 2.5mL,比色前加入DTNB显色液0.5mL用光径1cm杯,5min内在可见光423nm波长测OD值,以双蒸水调零点。
以GSH含量(μmol/L)为横坐标,OD423值为纵坐标,绘制标准曲线。
1.3.6.2.3.3 测定步骤:
| 试剂 | 样品管(mL) | 非酶管(mL) | 空白管(mL) |
|
1.0mmol/LGSH |
0.4 |
0.4 |
|
|
样品** |
0.4 |
|
|
|
双蒸水* |
|
0.4 |
|
|
37℃水浴预温5min |
|||
|
H2O2(37℃预热) |
0.2 |
0.2 |
|
|
37℃水浴准确反应3min (严格控制时间) |
|||
| 偏磷酸沉淀液 | 4 | 4 | |
| 3000r/min离心10min | |||
|
离心上清液 |
2 |
2 |
|
|
双蒸水 |
|
|
0.4 |
|
偏磷酸沉淀液 |
|
|
1.6 |
|
0.32mol/LNa2HPO4 |
2.5 |
2.5 |
2.5 |
| DTNB显色液 | 0.5 | 0.5 | 0.5 |
显色反应1min后于423nm波长(1cm光径),读OD值,5min之内读数准确。
* 样品为组织上清液时,非酶管改为加热使酶失活的组织上清液。
**溶血液 0.1-0.4mL
组织上清液 1:20稀释,取稀释液0.4mL
注:如用试剂盒,可按试剂盒的操作要求进行。
1.3.6.2.3.4 计算
鼠全血GSH-Px活力单位 规定每1mL全血,每分钟,扣除非酶反应的log[GSH]降低后,使log[GSH]降低1为一个酶活力单位。
非酶管log[GSH]-样品管log[GSH]
![]()
组织GSH-Px比活力单位 规定每毫克蛋白质,每分钟,扣除非酶反应,使GSH浓度降低1μmol/L为一个酶活力单位。
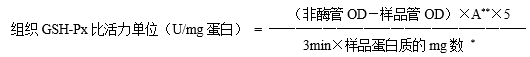
* Folin法或双缩脲法测样品蛋白质含量

1.3.6.2.4 注意事项
1.3.6.2.4.1 由于H2O2易分解导致浓度改变,临用时取贮备液用分光光度计测其浓度,取贮备液3mL,测定1cm光径的240nm处OD值。
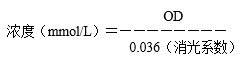
若OD值为0.45,则表明H2O2浓度为12.5mmol/L。
1.3.6.2.4.2 5-硫代2-硝基苯甲酸阴离子的显色不仅与整个反应体系中氢离子浓度有关,还受反应时间限制。加入显色剂后,反应体系pH为6.5时,11min开始显色,此时比色5min内读数准确。
1.3.7抗氧化物质还原型谷胱甘肽(GSH)测定
谷胱甘肽是一种低分子清除剂,它可清除O2-、H2O2、LOOH。谷胱甘肽是谷氨酸、甘氨酸和半胱氨酸组成的一种三肽,是组织中主要的非蛋白质的巯基化合物,是GSH-PX和GST两种酶类的底物,为这两种酶分解氢过氧化物所必需,它能稳定含巯基的酶,和防止血红蛋白及其它辅助因子受氧化损伤,缺乏或耗竭GSH会促使许多化学物质或环境因素产生中毒作用,GSH量的多少是衡量机体抗氧化能力大小的重要因素。
1.3.7.1血或组织中还原型谷胱甘肽(GSH)测定方法
1.3.7.1.1原理
GSH-和5,5'-二硫对硝基甲酸(DTNB)反应在GSH-Px催化下可生成黄色的5-硫代2-硝基甲酸阴离子,于420nm波长有最吸收峰,测定该离子浓度,即可计算GSH的含量。
1.3.7.1.2仪器和试剂
仪器:可见光分光光度计、酶标仪、低温高速离心机、匀浆器、恒温水浴锅、微量加样器
试剂:0.9%生理盐水
4%磺基水杨酸溶液
0.1mol/L PBS溶液(pH=8.0):
称取Na2HPO4 13.452g,KH2PO4 0.722g,加蒸馏水至1000mL。
0.004%DTNB溶液:
称取DTNB 40mg溶于1000mL的0.1mol/L PBS溶液(pH=8.0)中。
叠氮纳缓冲液:
|
NaN3 |
16.25 mg |
|
EDTA-Na2 |
7.44 mg |
|
Na2HPO4 |
1.732 g |
|
NaH2PO4 |
1.076 g |
加蒸馏水至1000mL,用少量HCl、NaOH调pH7.0,4℃保存。
标准溶液:称取还原型GSH 15.4mg,加叠氮纳缓冲液至50mL,终浓度为 1mmol/L,临用前配制。
1.3.7.1.3 实验步骤
1.3.7.1.3.1 样品制备:
溶血液上清液:取0.1mL抗凝全血加双蒸水0.9mL(1:9溶血液),充分混匀,直至透亮为止。取溶血液0.5mL加4%磺基水杨酸0.5mL混匀,室温下3500rpm离心10分钟,取上清液备用。
血清上清液:取0.1mL血清加4%磺基水杨酸0.1mL混匀,室温下3500rpm离心10分钟,取上清液备用。
组织上清液:取组织0.5g加生理盐水4.5mL充分研磨成细浆(10%肝匀浆),混匀后取浆液0.5mL加4%磺基水杨酸0.5mL混匀,室温下3500rpm离心10分钟,取上清液备用。
1.3.7.1.3.2 样品测定:
溶血液或组织样品测定:
|
|
测定管 |
空白管 |
|
上清液 |
0.5mL |
- |
|
4%磺基水杨酸 |
- |
0.5mL |
|
DTNB |
4.5mL |
4.5mL |
混匀,室温放置10 分钟后,420nm处测定吸光度。
血清样品测定:
|
|
测定管 |
空白管 |
|
上清液 |
0.1mL |
- |
|
4%磺基水杨酸 |
- |
0.1mL |
|
DTNB |
0.9mL |
0.9mL |
混匀,室温放置10 分钟后,420nm处测定吸光度。
注:该指标检测,需新鲜样品取材后当天完成。用双缩脲法测定血清(或溶血液)、组织匀浆蛋白质含量。如用试剂盒,可按试剂盒的操作要求进行。
1.3.7.1.3.3 标准曲线
取1mmol/L GSH标准溶液0、10、20、50、100、150、200µL,分别加入生理盐水至0.5mL,即得到0、20、40、100、200、300、400µmol/L的GSH标准液系列,各管加入DTNB4.5mL,混匀,室温放置10 分钟后,空白管调零,420nm处测定吸光度。以浓度为横坐标,吸光度为纵坐标,做标准曲线。
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
1mmol/L GSH(mL) |
0 |
0.01 |
0.02 |
0.05 |
0.10 |
0.15 |
0.20 |
|
生理盐水(mL) |
0.50 |
0.49 |
0.48 |
0.45 |
0.40 |
0.35 |
0.30 |
|
DTNB(mL) |
4.50 |
4.50 |
4.50 |
4.50 |
4.50 |
4.50 |
4.50 |
|
GSH量(mmol/L) |
0 |
20 |
40 |
100 |
200 |
300 |
400 |
|
|
|
|
|
1.3.7.1.3.4 计算
样品GSH含量 = 对应曲线浓度值(mmol/L)×溶血液稀释倍数×上清液稀释倍数
(mmol /L全血) = 对应曲线浓度值(mmol/L)×10×2
样品GSH含量 = 对应曲线浓度值(mmol/L)×上清液稀释倍数
(mmol /L血清) = 对应曲线浓度值(mmol/L)×2
样品GSH含量 = 对应曲线浓度值(mmol/L)×上清液稀释倍数÷上清液组织含量
(mmol /g组织) = 对应曲线浓度值(mmol/L)×2÷100g组织/L
样品GSH含量 = 对应曲线浓度值(mmol/L)×上清液稀释倍数÷上清液蛋白含量
(mmol /gprot) = 对应曲线浓度值(mmol/L)×2÷匀浆gprot/L
1.4数据处理与结果判定
1.4.1数据处理
一般采用方差分析,但需按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值< F0.05,结论:各组均数间差异无显著性;F值≥F0.05,P≤0.05,用多个实验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
1.4.2 指标判定
1.4.2.1脂质氧化产物
受试样品组与模型(或老龄)对照组比较,过氧化脂质(丙二醛或8-表氢氧异前列腺素)含量降低有统计学意义,判定该受试样品有降低脂质过氧化作用,该项指标结果阳性。
1.4.2.2蛋白质氧化产物
受试样品组与模型(或老龄)对照组比较,蛋白质羰基含量降低有统计学意义,判定该受试样品有降低蛋白质过氧化作用,该项指标结果阳性。
1.4.2.3抗氧化酶活力
受试样品组与模型(或老龄)对照组比较,抗氧化酶(SOD或GSH-PX)活力升高有统计学意义,判定该受试样品有升高抗氧化酶活力作用,该项指标结果阳性。
1.4.2.4抗氧化物质GSH
受试样品组与模型(或老龄)对照组比较,GSH含量升高有统计学意义,判定该受试样品有升高抗氧化物质GSH作用,该项指标结果阳性。
1.4.3结果判定
过氧化脂质含量、蛋白质羰基、抗氧化酶活性、还原性谷胱甘肽四项指标中三项指标阳性,可判定该受试样品抗氧化动物实验结果阳性。
2 人体试食试验
2.1 受试者纳入标准
选年龄在18-65岁,身体健康状况良好,无明显脑、心、肝、肺、肾、血液疾患,无长期服药史,志愿受试保证配合的人群。
2.2 排除受试者标准
2.2.1妊娠或哺乳期妇女,对保健食品过敏者。
2.2.2合并有心、肝、肾和造血系统等严重疾病患者。
2.2.3短期内服用与受试功能有关的物品,影响到对结果的判断者。
2.2.4不符合纳入标准,未按规定食用受试样品,无法判定功效或资料不全影响功效或安全性判断者。
2.3 受试者分组
对受试者按MDA、SOD、GSH-Px水平随机分为试食组和对照组,尽可能考虑影响结果的主要因素如年龄、性别、生活饮食习惯等,进行均衡性检验,以保证组间的可比性。每组受试者不少于50例。
2.4 试验方法
采用自身和组间两种对照设计。试验组按推荐服用方法、服用量每日服用受试产品,对照组可服用安慰剂或采用阴性对照。受试样品给予时间3个月,必要时可延长至6个月。试验期间对照组和试食组原生活、饮食不变。
2.5 观察指标
各项指标在试验开始及结束时各检测1次。
2.5.1 安全性指标
2.5.1.1 一般状况 包括精神、睡眠、饮食、大小便、血压等
2.5.1.2 血、尿、便常规检查
2.5.1.3 肝、肾功能检查
2.5.1.4 胸透、心电图、腹部B超检查
2.5.2功效指标
2.5.2.1 过氧化脂质含量 观察试验前后MDA的变化及MDA下降百分率。(测定方法见1.3.3.1)

观察试验前后8-Isoprostane的变化及8-Isoprostane下降百分率。(测定方法见2.8)

2.5.2.2 超氧化物歧化酶 观察试验前后SOD的变化及SOD升高百分率。(测定方法见1.3.4.1)

2.5.2.3 谷胱甘肽过氧化物酶 观察试验前后GSH-PX的变化及GSH-PX升高百分率。(测定方法见2.7)

2.6数据处理和结果判定
凡自身对照资料可以采用配对t检验,两组均数比较采用成组t检验,后者需进行方差齐性检验,对非正态分布或方差不齐的数据进行适当的变量转换,待满足正态方差齐后,用转换的数据进行t检验;若转换数据仍不能满足正态方差齐要求,改用t’检验或秩和检验;但变异系数太大(如CV>50%)的资料应用秩和检验。在试验前组间比较差异无显著性的前提下,可进行试验后组间比较。
各功效观察指标试验前后自身比较和试食后组间比较均有统计学意义,方可判定该指标阳性。
过氧化脂质含量、超氧化物歧化酶、谷胱甘肽过氧化物酶三项实验中任二项实验结果阳性,可判定该受试样品具有抗氧化功能作用。
2.7 血中谷胱甘肽过氧化物酶(GSH-Px)活力测定
2.7.1 原理
谷胱甘肽过氧化物酶(GSH-Px)是体内存在的一种含硒清除自由基和抑制自由基反应的系统。对防止体内自由基引起膜脂质过氧化特别重要,其活力以催化GSH氧化的反应速度,及单位时间内GSH减少的量来表示,GSH和5,5’-二硫对硝基苯甲酸(DTNB)反应在GSH-Px催化下可生成黄色的5-硫代2-硝基苯甲酸阴离子,于423nm波长有最大吸收峰,测定该离子浓度,即可计算出GSH减少的量,由于GSH能进行非酶反应氧化,所以最后计算酶活力时,必须扣除非酶反应所引起的GSH减少。
2.7.2 试剂和仪器
仪器:可见光分光光度计、酶标仪、恒温水浴锅、微量加样器、离心机
试剂:叠氮钠磷酸缓冲液 pH7.0
|
NaN3 |
16.25mg |
终浓度2.5mmol/L |
|
EDTA-Na2 |
7.44mg |
终浓度0.2mmol/L |
|
Na2HPO4 |
1.732g |
终浓度0.2mol/L |
|
NaH2PO4 |
1.076g |
终浓度0.2mol/L |
加蒸馏水至100mL,用少量HCL、NaOH调pH7.0,4℃保存。
1mmol/L谷胱甘肽(还原型GSH)溶液
GSH 30.7mg加叠氮钠磷酸缓冲液至100mL,临用前配制,冰冻保存1-2日。
1.25-1.5mmol/L H2O2溶液
取30%H2O2 0.15-0.17mL,用双蒸水稀释至100mL,作为贮备液,4℃避光保存,临用前将贮备液用双蒸水稀释10倍即可。
偏磷酸沉淀液
|
HPO3 |
16.7g(先用蒸馏水溶解) |
|
EDTA |
0.5g |
|
NaCl |
280g |
加蒸馏水至1000mL,用普通滤纸过滤,室温保存。
0.32mol/L Na2HPO4溶液:
Na2HPO4 22.7g加蒸馏水至500mL,室温保存。
DTNB显色液
|
DTNB |
40mg |
|
柠檬酸三钠 |
1.0g |
加蒸馏水至100mL,4℃避光保存1个月。
2.7.3 实验步骤
2.7.3.1 样品制备
溶血液:取血20μl加入到1mL 双蒸水中,充分振摇,使之全部溶血1:100待测,4小时内测定酶活力。若当天来不及测定,将肝素抗凝全血置-20℃冻存,3天内测定,若4℃存放,28小时内必须测完。测前取出样品室温自然解冻,
2.7.3.2 GSH标准曲线的制作:
取1.0mmol/L GSH溶液0、0.2、0.4、0.6、0.8、1.0mL,分别置于10mL小容器瓶中,各加入偏磷酸沉淀剂8mL,用双蒸水稀释至10mL刻度,即得到浓度为0、20、40、60、80、100μmol/L的 GSH标准液。
取上述不同浓度标准液各2mL,放入试管中,加入0.32mol/L Na2HPO4 2.5mL,比色前加入DTNB显色液0.5mL用光径1cm杯,5min内在可见光423nm波长测OD值,以双蒸水调零点。
以GSH含量(μmol/L)为横坐标,OD423值为纵坐标,绘制标准曲线。
2.7.3.3 测定步骤:
|
试剂 |
样品管(mL) |
非酶管(mL) |
|
1.0mmol/L GSH |
0.4 |
0.4 |
|
血样稀释液 |
0.4 |
|
|
双蒸水 * |
|
0.4 |
|
37℃水浴预温5min |
||
|
H2O2(37℃预热) |
0.2 |
0.2 |
|
37℃水浴准确反应5min(严格控制时间) |
||
|
偏磷酸沉淀液 |
4 |
4 |
|
3000r/min离心10min |
||
|
离心上清液 |
2 |
2 |
|
双蒸水 |
|
|
|
偏磷酸沉淀液 |
|
|
|
0.32mol/L Na2HPO4 |
2.5 |
2.5 |
|
DTNB显色液 |
0.5 |
0.5 |
显色反应1min后于423nm波长(1cm光径),读OD值,5min之内读数准确。
2.7.3.4 计算
全血GSH-Px活力单位 规定每8μl全血,在37℃反应5min,扣除非酶反应后,使GSH浓度降低1μmol/L浓度为一个酶活力单位。
全血GSH-Px活力U/mL血=(非酶管OD-样品管OD)×A*×5**

** 5 换算成1mL反应液中GSH浓度时,需乘以稀释倍数5
2.7.3.5 注意事项
2.7.3.5.1 由于H2O2易分解导致浓度改变,临用时取贮备液用分光光度计测其浓度,取贮备液3mL,测定1cm光径的240nm处OD值。

若OD值为0.45,则表明H2O2浓度为12.5mmol/L。
2.7.3.5.2 5-硫代2-硝基苯甲酸阴离子的显色不仅与整个反应体系中氢离子浓度有关,还受反应时间限制。加入显色剂后,反应体系pH为6.5时,11min开始显色,此时比色5min内读数准确。
2.8 血清中8-表氢氧-异前列腺素(8-Isoprostane)测定
2.8.1原理
8-表氢氧-异前列腺素(8-Isoprostane)是体内脂质氧化应激反应稳定而具有特异性的标志物,其含量能间接反应因机体内自由基的产生而导致组织细胞的脂质过氧化程度。
2.8.2仪器与试剂
仪器:酶标仪、生化培养箱、微量振荡器、微量加样器、洗板机
试剂:8-Isoprostane KIA Kit (酶联免疫试剂盒)
8-Isoprostane EIA 抗体血清、8-Isoprostane AChE示踪物、8-Isoprostane EIA标准品、EIA缓冲液、洗涤缓冲液、吐温20、鼠抗-兔IgG抗体、EIA示踪染色剂、EIA抗体血清染色剂、Ellman’s试剂
2.8.3实验步骤
2.8.3.1样品制备
静脉取血,3000r/min离心10min。取上清液,用EIA 缓冲液稀释15倍备用。
2.8.3.2样品测定
按试剂盒说明操作。
8-表氢氧异前列腺素标准孔浓度分别为:500 pg/mL、200 pg/mL、80 pg/mL、32 pg/mL、12.8 pg/mL、5.1 pg/mL、2.0 pg/mL、0.8pg/mL
|
步骤 |
试剂 |
空白 |
TA |
NSB |
B0 |
标准/样品 |
|
1.加试剂 |
EIA 缓冲液 |
- |
- |
100μL |
50μL |
- |
|
标准/样品 |
- |
- |
- |
- |
50μL |
|
|
AChE示踪物 |
- |
- |
50μL |
50μL |
50μL |
|
|
抗体血清 |
- |
- |
- |
50μL |
50μL |
|
|
2.培养 |
用封板膜盖好酶标板,并在4℃避光条件下培养18小时 |
|||||
|
3.清洗 |
清洗所有反应孔五次 |
|||||
|
4.加试剂 |
AChE示踪物 |
- |
5μL |
- |
- |
- |
|
Ellman’s |
200μL |
200μL |
200μL |
200μL |
200μL |
|
|
5.培养 |
用封板膜盖好酶标板,并在常温避光条件下培养45-90分钟 |
|||||
|
6.读数 |
在波长412nm处测量各孔吸光度(B0在 0.3-1.0 A.U范围) |
|||||

以标准物的浓度的对数(log)为横坐标,%B/B0为纵坐标绘制标准曲线,亦可将数据转换成logit(B/B0)或ln[B/B0/(1-B/B0)]做为纵坐标绘制标准曲线,计算回归方程。将样品的%B/B0值,代入方程式,计算出样品的浓度,再乘以稀释倍数,即为样品中的8-表氢氧异前列腺素浓度。